Bien qu’étant une innovation relativement récente sur le marché́ des intrants agricoles, les biostimulants font l’objet de nombreux axes de recherche, constituant une base documentaire riche. Certains d’entre eux sont élaborés à partir de micro-organismes bactériens dits d’intérêt agricole. Ces bactéries qui vivent au niveau de la rhizosphère et dont les principaux mécanismes impactent le sol et les plantes ont été qualifiées par la communauté scientifique de PGPR, pour Plant Growth-Promoting Rhizobacteria. On retrouve aujourd’hui de nombreux produits à base de ces micro-organismes bactériens commercialisés en France qui ont été homologués par l ‘ANSES. Préalablement à l’autorisation de mise en marché qu’elle délivre, l’ANSES, évalue l’invariance, l’homogénéité des produits au niveau des process industriels, leur stabilité, leur innocuité (vis-à-vis de l’homme et de l’environnement) ainsi que leur efficacité.
Les biostimulants bactériens, une panoplie de mécanismes à usage des plantes
La rhizosphère, région située à proximité́ directe des racines, constitue une zone particulièrement dense et riche en vie biologique dans le sol (Antoun, 2013). En effet, les plantes libèrent via des exsudations racinaires des ions et des composés qui vont perturber localement l’équilibre du sol (Walker et al., 2003). Ces composés sont principalement des molécules carbonées, dont des sucres, acides organiques, acides aminés et acides phénoliques. Ils vont dès lors attirer des organismes pouvant être bénéfiques, pathogènes ou sans impact pour la plante (Badri & Vivanco, 2009). C’est dans cet environnement que vont s’installer des micro-organismes dont les stratégies de développement sont étroitement liées aux végétaux avec lesquels ils évoluent. Cette partie vise à décrire les interactions entre les végétaux et des bactéries bénéfiques, les PGPR, ainsi que leur exploitation en agriculture.
Impacts des PGPR sur leur environnement et mécanismes mis en jeu
Les PGPR (Plant Growth-Promoting Rhizobacteria), sont définies comme des bactéries présentes dans la rhizosphère, pour lesquelles un effet positif sur la physiologie végétale est reconnu. D’après Kloepper (1993), les PGPR se distinguent par leur capacité́ à coloniser la surface racinaire, survivre, se multiplier et être compétitif vis-à-vis des autres micro- organismes, tout en stimulant la croissance des plantes. Dans la rhizosphère, ces bactéries peuvent se retrouver aux niveaux intra ou extracellulaire (Gray & Smith, 2005). Au niveau intracellulaire, les bactéries sont dites endophytiques et colonisent l’apoplaste. Ces bactéries font parties de la famille des Rhizobiums. Généralement symbiotiques, ce sont notamment les PGPR spécialisées dans les structures nodales des Fabaceae. Au niveau extracellulaire, elles sont localisées en surface ou à proximité́ des racines, elles sont donc rhizosphériques (Vessey, 2003).
Quatre effets principaux ont été́ identifiés chez ces PGPR. Elles peuvent augmenter la disponibilité́ des éléments nutritifs, réguler la production de phytohormones, augmenter la tolérance aux stress abiotiques et inhiber les bio agresseurs par compétition (Glick, 2012 ; Souza, 2015).
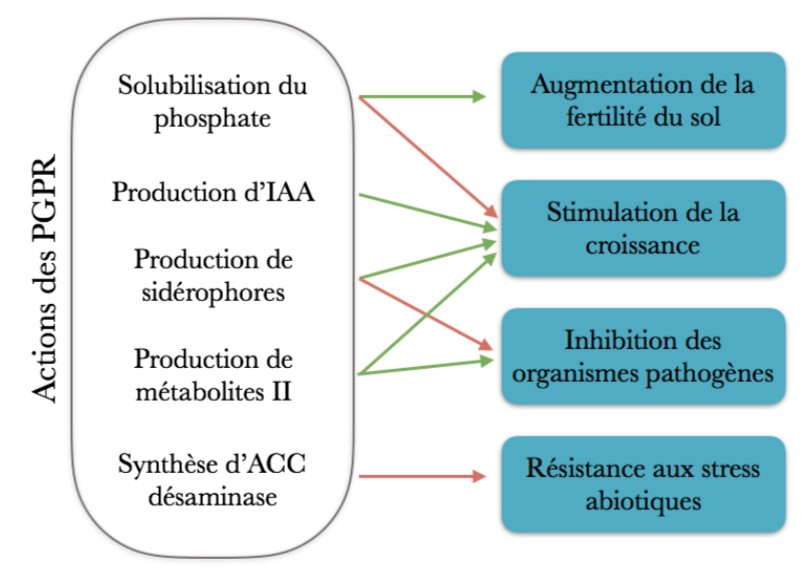
Mécanismes de l’intéraction Plante-PGPR (Flèches vertes : effets directs ; flèches rouges : effets indirects)
1. Augmentation de la disponibilité́ des éléments nutritifs
La croissance végétale peut être favorisée indirectement par une meilleure fertilité du sol en éléments nutritifs de base (N, P, K) et en oligoéléments.
Le phosphore (P) est, avec l’azote et le potassium, un des principaux facteurs limitants de la croissance végétale. Bien que le P ne soit pas rare dans les sols, il est majoritairement présent sous des formes insolubles (complexes organiques, apatite), non disponibles pour le prélèvement par les plantes. La solubilisation du phosphore représente une solution pour augmenter la concentration de P sous des formes biodisponibles (H2PO4-, HPO42-) sans apport exogène d’engrais minéral. Il existe pour cela des bactéries capables de solubiliser le phosphore inorganique, dites phosphate-solubilizing bacteria (PSB) (Zaidi et al., 2012). Elles mettent en jeu des molécules de faible poids moléculaires telles que l’acide citrique, l’acide gluconique ou l’acide oxalique (Glick, 2012). Leur production est contrôlée par des métabolites secondaires libérés par les bactéries. Par exemple, la PQQ, pour PyrroloQuinoline Quinone, intervient dans la production d’acide gluconique (Van Schie et al., 1987). Un deuxième mécanisme de mise à disposition du P organique est réalisé́ via des phytases. Ces molécules sont des phosphatases capables d’hydrolyser des complexes organiques, les phytates, dans lesquels le P est piégé́ (Gerke, 2015). Leur hydrolyse permet la libération de P inorganique sous forme de groupement phosphate. Des bactéries du genre Pseudomonas, Bacillus, par exemple, ont été́ identifiées comme contenant des phytases (Konietzny & Greiner, 2004).
Le fer (Fe) fait partie des oligoéléments essentiels des végétaux. Il est présent de manière abondante dans les sols sous sa forme ferrique (Fe3+). Or, à l’instar du P, cette forme est peu soluble et difficile à acquérir par les plantes (Morrissey & Guerinot, 2010). Son absorption nécessite alors un transporteur. Certaines bactéries sont capables de libérer des sidérophores, des molécules de faible poids moléculaire ayant une forte affinité́ pour le fer (Neilands, 1995). Ces sidérophores peuvent former des complexes sidérophore-Fe3+ pour extraire, chélater et transporter le fer à proximité des racines. Ce complexe est reconnu au niveau racinaire par des récepteurs protéiques spécifiques, où il peut être absorbé (Morrissey & Guerinot, 2010). Les plantes produisent elles-mêmes des phytosidérophores, les PGPR permettent donc de renforcer ce mécanisme.
Ces sidérophores présentent aussi un intérêt contre les bioagresseurs, développé plus loin (§ 4).
A noter : Cette dernière revendication ne relève pas du champ réglementaire des biostimulants mais de celui des produits de biocontrôle.
Enfin, les bactéries dites diazotrophes sont capables de convertir le diazote atmosphérique (N2) en ammoniac (NH3). Bien que les plus courantes soient les bactéries en symbiose avec les légumineuses, LES RHIZOBIUMS, il existe également des bactéries diazotrophiques non symbiotiques du genre Azospirillum, Azotobacter, Pseudomonas ou Klebsiella (Dobbelaere et al., 2003).
2. Stimulation de la croissance par production de phytohormones
Les phytohormones sont des molécules naturellement produites par les plantes, qui peuvent avoir pour effet de stimuler ou d’inhiber la croissance végétale. Les phytohormones qui interviennent dans la stimulation de la croissance regroupent les molécules de trois familles principales, les auxines, les cytokinines et les gibbérellines (Bouriquet, [sans date]). Certaines PGPR sont capables de produire ces hormones.
Les auxines d’origine végétale sont connues pour inhiber la croissance du bourgeon terminal, mais sont également impliquées dans la croissance et la différenciation cellulaire. Elles participent à l’élongation et à la prolifération cellulaire, à la rhizogenèse et autres organogenèses, ainsi qu’à la transcription (Bohn-Courseau, 2010 ; Bouriquet). L’IAA, pour acide indole-3-acétique, est l’auxine majoritaire dans les plantes et la plus étudiée (Bohn-Courseau, 2010). Lorsqu’elle est synthétisée par les bactéries, elle a deux fonctions principales. L’IAA bactérienne stimule l’augmentation de la surface et de la longueur racinaire, donnant accès à la plante à un volume d’exploration du sol important pour une meilleure acquisition des éléments nutritifs (Glick, 2012). Cependant, une production excessive d’IAA peut inhiber la croissance racinaire et entraver le développement normal de la plante (Xie et al., 1996). Deuxièmement, l’IAA permet un relâchement des parois cellulaires au niveau des radicelles afin de faciliter les exsudations, sources d’énergie pour le développement bactérien (Glick, 2012). Elle intervient également dans la germination.
Le rôle des gibbérellines s’exprime principalement dans l’élongation cellulaire au niveau des méristèmes, induisant l’élongation des tiges et la croissance racinaire. Elles interviennent également dans la levée de la dormance et l’induction florale (Nambara, 2013). Des bactéries peuvent produire des gibbérellines en tant que métabolites secondaires, intervenant dans les voies de signalisation des interactions plante-bactérie (Bottini et al., 2004). Dans ce cas, la gibbérelline permet de stimuler la croissance aérienne et racinaire et de maintenir la structure de la plante («vigueur») (Bottini et al., 2004). Les cytokinines, en combinaison avec l’auxine, servent à la prolifération des tissus via la stimulation de la division cellulaire, de l’organogenèse et de la différenciation de certains organes (Nambara, 2013). Enfin, ces molécules interviennent dans le ralentissement du vieillissement des feuilles (Bouriquet).
Les phytohormones ont ainsi un rôle direct sur la croissance végétale, mais peuvent aussi intervenir dans d’autres voies métaboliques et de signalisation.
3. Augmentation de la tolérance aux stress abiotiques
Les conditions de stress déclenchent chez les plantes des voies de signalisation et des réponses physiologiques. Elles sont modulées par des molécules spécifiques.
L’éthylène est une phytohormone qui joue un rôle de signalisation pour de nombreux processus physiologiques. Elle intervient notamment en réponse aux stress d’origine abiotique (e.g. sécheresse, salinité́, pollutions par des métaux) (Druege, 2006). Lorsque l’éthylène est produit de manière importante, elle va inhiber la croissance végétale et induire des phénomènes de sénescence, de chlorose, la chute des feuilles voire la mort de la plante (Glick, 2014). L’ACC – pour acide 1-aminocyclopropane carboxylique – est le précurseur direct de l’éthylène. Il peut être clivé par l’ACC déaminase, une enzyme secrétée par des bactéries telles que Pseudomonas putida ou Azospirillum brasilense (Bashan & De-Bashan, 2005). Ces PGPR utilisent les produits de dégradation de l’ACC – ammoniaque et ketobutyrate – comme source d’énergie, et sont ainsi capables de moduler la production d’éthylène (Glick, 2014). En conséquence, la croissance de la plante est maintenue en conditions de stress.
4. Inhiber les bioagresseurs par compétition
Le but premier des PGPR utilisées comme biostimulants n’est pas la compétition contre les bioagresseurs. Néanmoins cela peut avoir un effet indirect sur la protection et la croissance de la plante.
Aux alentours des racines, les micro-organismes sont en concurrence pour l’accès aux éléments nutritifs tels que le carbone ou le fer, et donc pour l’espace. Les sidérophores libérés par les PGPR permettent de piéger le Fe dans des complexes que les agents pathogènes du sol ne sont pas capables d’utiliser. Il semble également que les sidérophores produits par les PGPR ont une affinité pour le Fe plus élevée que les chélateurs libérés par les autres organismes, ce qui leur confère un avantage compétitif (Glick, 2012 ; Kloepper et al., 1980). Le rôle des sidérophores est ainsi double : d’une part ils servent à la nutrition des bactéries PGPR et de la plante, d’autre part ils amenuisent les réserves pour les microorganismes pathogènes.
Pour rappel : cette revendication n’est pas une propriété des biostimulants mais réfère au biocontrôle.
Pour en savoir plus : Vulgarisation à la microbiologie
BIBLIOGRAPHIE
BASHAN, Y. et DE-BASHAN, L.E., 2005. BACTERIA | Plant Growth-Promoting. In : Encyclopedia of Soils in the Environment. Oxford : Elsevier. p. 103-115. ISBN 978-0-12-348530-4.
KLOEPPER, J.W., LEONG, J., TEINTZE, M., SCHROTH, M.N., 1980. Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria. In : Nature. Vol. 286, n°1, p. 885-886. DOI 10.1038/286885a0.
DRUEGE, Uwe, 2006. Ethylene and Plant Responses to Abiotic Stress. In : KHAN, Dr Nafees A. (éd.), Ethylene Action in Plants. S l. : Springer Berlin Heidelberg. p. 81-118. ISBN 978-3-540-32716-5.
GLICK, B.R., 2012. Plant Growth-Promoting Bacteria: Mechanisms and applications. In: Scientifica. Octobre 2012. Vol. 2012, p. 1-15. DOI 10.6064/2012/963401.
GLICK, B.R., 2014. Bacteria with ACC deaminase can promote plant growth and help to feed the world. In : Microbiological Research. Janvier 2014. Vol. 169, n° 1, p. 30-39. DOI 10.1016/j.micres.2013.09.009.
VESSEY, K., 2003. Plant growth-promoting rhizobacteria as biofertilizers. In : Plant and soil. 2003. Vol. 255, p. 571-586.
SOUZA, R. de, AMBROSINI, A. et PASSAGLIA, L.M.P., 2015. Plant growth-promoting bacteria as inoculants in agricultural soils. In : Genetics and Molecular Biology. 2015. Vol. 38, p. 401 – 419.
ZAIDI, A., AHMAD, E., KHAN, M.S., SAIF, S. et RIZVI, A., 2015. Role of Plant Growth Promoting Rhizobacteria in sustainable production of vegetables: Current perspective. In: Scientia Horticulturae. Septembre 2015. Vol. 193, p. 231-239. DOI 10.1016/j.scienta.2015.07.020.
KONIETZNY, U. et GREINER, R., 2004. Bacterial phytase: potential application, in vivo function and regulation of its synthesis. In : Brazilian Journal of Microbiology. Juin 2004. Vol. 35, n° 1-2, p. 12-18. DOI 10.1590/S1517-83822004000100002
MORRISSEY, J. et GUERINOT, M.L., 2009. Iron uptake and transport in plants: The good, the bad, and the ionome. In : Chemical reviews. Octobre 2009. Vol. 109, n° 10, p. 4553-4567. DOI 10.1021/cr900112r.
DOBBELAERE, S., VANDERLEYDEN, J. et OKON, Y., 2003. Plant growth-promoting effects of diazotrophs in the rhizosphere. In : Critical Reviews in Plant Sciences. Mars 2003. Vol. 22, n° 2, p. 107-149. DOI 10.1080/713610853.
XIE, H., PASTERNAK, J.J. et GLICK, B.R., 1996. Isolation and characterization of mutants of the plant growth-promoting rhizobacterium Pseudomonas putida GR12-2 that overproduce indoleacetic acid. In : Current Microbiology. Vol. 32, n° 2, p. 67-71. DOI 10.1007/s002849900012.
DOBBELAERE, S., VANDERLEYDEN, J. et OKON, Y., 2003. Plant growth-promoting effects of diazotrophs in the rhizosphere. In : Critical Reviews in Plant Sciences. Mars 2003. Vol. 22, n° 2, p. 107-149. DOI 10.1080/713610853.
BOHN-COURSEAU, I., 2010. Auxin: A major regulator of organogenesis. In: Développement végétatif des plantes, Georges Pelletier, Jean-François Morot-Gaudy. Avril 2010. Vol. 333, n° 4, p. 290-296. DOI 10.1016/j.crvi.2010.01.004.
NAMBARA, E., 2013. Plant Hormones A2 – Maloy, Stanley. In : HUGHES, Kelly (éd.), Brenner’s Encyclopedia of Genetics (Second Edition). San Diego : Academic Press. p. 346-348. ISBN 978-0-08-096156-9.
CHOUDHARY, D.K., PRAKASH, A. et JOHRI, B.N., 2007. Induced systemic resistance (ISR) in plants: mechanism of action. In : Indian Journal of Microbiology. Décembre 2007. Vol. 47, n° 4, p. 289-297. DOI 10.1007/s12088-007-0054-2.
SOMERS, E., VANDERLEYDEN, J. et SRINIVASAN, M., 2004. Rhizosphere Bacterial Signalling: A Love Parade Beneath Our Feet. In : Critical Reviews in Microbiology. 1 janvier 2004. Vol. 30, n° 4, p. 205-240. DOI 10.1080/10408410490468786.
VAN LOON, L.C., BAKKER, P.A.H.M. et PIETERSE, C.M.J., 1998. Systemic resistance rnduced by rhizosphere bacteria. In : Annual Review of Phytopathology. September 1998. Vol. 36, n° 1, p. 453-483. DOI 10.1146/annurev.phyto.36.1.453.
VERHAGEN, B.W.M., TROTEL-AZIZ, P., COUDERCHET, M, HÖFTE, M. et AZIZ, A., 2010. Pseudomonas spp.-induced systemic resistance to Botrytis cinerea is associated with induction and priming of defense responses in grapevine. In : Journal of Experimental Botany. 2010. Vol. 61, n° 1, p. 249-260. DOI 10.1093/jxb/erp295.
BOURIQUET, R. « Phytohormones ou hormones végétales ». In : Universalis éducation [en ligne]. Encyclopædia Universalis, consulté le 21 avril 2016. Disponible sur http://www.universalis- edu.com/encyclopedie/phytohormones-hormones-vegetales/
